Schädlinge.
Dekontamination von Schadstoffen
Schadstoffe können in Gebäuden vorkommen und/oder an musealen Objekten enthalten sein.
Eine Übersicht zu Gefahrstoffen gibt die deutsche Gefahrstoffverordnung (GefStoffV), zu finden auf der Homepage der BAUA (Bundesanstalt für Arbeitsschutz und Arbeitsmedizin), die umfassende Schutzmaßnahmen für Beschäftigte bei Tätigkeiten mit verschiedenen Gefahrstoffen regelt.
Eigenschaften von Gefahrstoffen
- aktut toxisch (Aufnahmewege über Atmung oder Haut)
- hautreizend
- keimzellmutagen
- hautsensibilisierend
- toxisch bei wiederholter Applikation
Übersicht über Schadstoffe in Gebäuden
- Rückstände im Hausstaub (Insektizide, Fungizide)
- Giftige Stäube (Asbest, Arsen, DDT, Naphtalin usw.)
- Schimmelpilze
- Holzschutzmittelrückstände
- Taubenkot (biologisch)
Technische Schutzmaßnahmen
- Vermeiden oder vermindern von Schadstoffexpositionen
- Be-/Entlüftung von Räumen
- Personenbezogene Maßnahmen (Körperschutz, PSA)
- Dekontamination mit staubbeseitigenden Maschinen (z.B. Industriesauger mit Spezialfiltern)
- Schadstoffmessungen / Analytik
Eine Übersicht von verschiedenen Verfahren zur Abreicherung von Schadstoffen am Holz findet sich in nachfolgender Literaturquelle:
Dekontamination von Holzschutzmittel belastetem Holz nach WTA-Merkblatt* 1-8 (2013) Teil 1
- Luft- und bautechnische Maßnahmen
- Mechanische Reinigungsverfahren
- Mechanisch/Abrasive Verfahren
- Maskierungen
- Absperrungen/Barrieren
- Lösemittelextraktion
- Thermische Verfahren
- Unterdruckdesorption
- Laserstrahlen
- Abbeizen
- Bauteilbezogene Anwendung
- Erfolgskontrolle
*Bezug von WTA-Merkblättern über die WTA-Geschäftsstelle
Digitales Schädlingsmanagement
Moderne Schädlingskontrolle und -bekämpfung mit technischer Unterstützung
(weiterlesen…)DIN EN 16790 Integrierte Schädlingsbekämpfung (IMP)
Ein europäischer Standard für den Schutz kulturellen Erbes vor Schädlingen, einschließlich Insekten, Nagetiere und Mikroorganismen, wie z.B. Pilze. Das Ziel dieser DIN-Norm ist es, als Managementinstrument zu dienen und Leitlinien und aktuelle Verfahren der integrierten Schädlingsbekämpfung zu beschreiben.
(weiterlesen…)Dokumentation
Integriertes Schädlingsmanagement schriftlich festhalten und regelmäßig nutzen
(weiterlesen…)Erfolgskontrolle von Behandlungen
Überprüfung von Behandlungen (wie z.B. Begasung oder Wärmeverfahren) mit Referenzorganismen (Biotests) zum Nachweis des Bekämpfungserfolges. Nachfolgende Tierproben können zum Einsatz kommen, die man bei spezialisierten Laboren* bestellen und auswerten lassen kann:
Übersicht von verschiedenen Referenzorganismen
Hausbockkäfer (Larven in Holz)
Gewöhnlichen Nagekäfer (Larven im Holz)
Splintholzkäfer (Larven im Holz oder Ei-Gelege)
Kleidermotten (Brutgemisch auf Federn)
Pelzmotten (Brutgemisch auf Federn)
Brotkäfer (Brutgemisch in Gazeröhrchen)
Polsterwarenkäfer (Larven)
Verschiedene Vorratsschädlinge (z.B. Brotkäfer, Speckkäfer, Kugelkäfer, Reismehlkäfer, Mehlmotte usw.)
Termiten (z.B. Reticulitermes flavipes)
*Spezialisierte Fachlabore können auf Nachfrage vermittelt werden: Kontakt
Literatur
Haustein (2010) Zur Diagnose und integrierten Bekämpfung Holz zerstörender Insekten unter besonderer Berücksichtigung der Buntkäfer. Fraunhofer IRB Verlag Stuttgart, Seite 111
Landsberger B. (2014) How to ensure achievement of anoxia treatments? The use of target insect species as reference testing material. In: MuseumPests 2014: Integrated Pest Management for Museums, Libraries, Archives and Historic Sites, 27-28 March 2014, Williamsburg, VA
Rathgen-Forschungslabor (2018) Innovative Untersuchungsmethoden zur nachhaltigen Wirksamkeit modellhafter Anoxia-Behandlungen gegen Insektenbefall an national bedeutsamen Kulturgütern der Sammlungen der Stiftung Preußischer Kulturbesitz (DBU AZ 31865-45), 37 Seiten DBU-Abschlussbericht-AZ-31865.pdf
Gammastrahlung
Physikalisches Sonderverfahren zur Schimmelpilz- und Insektenbekämpfung
(weiterlesen…)Hygiene / Reinigung
Fehlende Reinigung und Hygiene kann zu unterschiedlichen Schädlingsproblemen mit Folgeschäden an Exponaten führen.
Ausstellungs- und Publikumsbereiche
Neben der täglichen Unterhaltsreinigung von Ausstellungsräumen sollten in regelmäßigen Abständen auch nachfolgende Bereiche kontrolliert und bei Bedarf gereinigt werden:
- Hohlräume hinter und unter Vitrinen, Schränken und Sockeln.
- Filzbespannungen in Vitrinen und Dichtungsleisten aus Echthaar-Filz
- Kabel- oder Lüftungskanäle in Wand und Bodenbereich
- Heizungsnischen im Wandbereich
- Spalten zwischen Böden und Wänden (siehe nachfolgendes Bild)
- Bodenkanäle für Lüftung oder Elektroanschlüsse
Neben den Ausstellungsräumen ist speziell auf direkte Nebenräume, wie Abstellkammern, Technikräume, Elektro- oder Lüftungszentralen usw. zu achten. In manchen Fällen können auch abgehängte Decken mit offenen Fugen zum darunter befindlichen Innenraum verschmutzt sein und können über Wartungsklappen kontrolliert werden.

Rückstände in Bodenfugen mit Haaren und Wollabrieb
Spinnweben in einem Ausstellungsraum eines großen europäischen Museums


Kehrbesen in einem Außendepot eines Museums
Depots, Magazine und Lagerräume
Speziell in Depots, Magazinen oder Lagerräumen mit hoher Auslastung durch Exponate und schwerer Zugänglichkeit zum Reinigen ist es für Schädlinge oft günstig sich zu vermehren und auszubreiten. Nachfolgende Bereiche oder Gegenstände sollten bei der Reinigung und Kontrolle beachtet werden:
- Dachböden und Keller, die nicht genutzt werden
- Ausstellungsmaterial, welches nicht mehr verwendet wird und Nahrungspotential für Insekten hat (z.B. Filzbespannung in Vitrinen)
- Verpackungsmaterial, das Nahrungspotential für Insekten hat (z.B. Papier, Kartons, Transportkisten aus Tischlerplattenholz mit Gabufurnier)
- Regalböden in Magazinen.
- Oberseiten von Kanälen von Klimaanlagen (soweit zugänglich)
Für die Reinigung wird ein museumstauglicher Sauger mit HEPA-Filter empfohlen, wenn es sich um Feinstaub, Schimmelpilze, Bakterien o.ä. handelt. Staubaufwirbelnde Arbeiten sind zu vermeiden. Die regelmäßige Wartung von Klimaanlagen dient zum Austausch verschmutzter Filter im System.
Literatur
Lloyd H. et al (2007) Dust in Historic Libraries. Museum Microclimates, The National Museum of Denmark, Copenhagen. 135-144
Wimmer M. (2023) Der Dreck muss weg. Oder? Theorie und Praxis von Schmutz und Reinigen im Freilichtmuseum Glentleiten. In: Jahrbuch für die oberbayer. Freilichtmuseen Glentleiten und Amerang. S.127-139
The British Museum Blog: What Lurks Under The Microscope? Dust Detective Work (Zugriff am 15.08.2021)
IADS
Insekten-Aktivitäts-Detektions-System zur Kontrolle von holzzerstörenden Larven


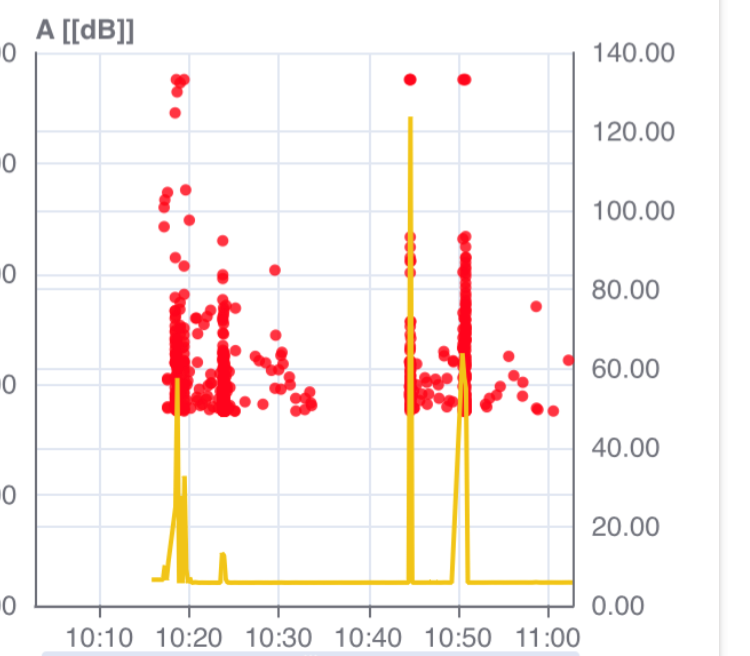
Ein Forschungsverbund unter der Leitung des Fraunhofer-Instituts für Holzforschung WKI hatte bereits über sein Forschungsprojekt „Insect Detect, Detektion aktiver Schadinsekten im Holzhandel“ in verschiedenen Fachzeitungen und in DpS-Online 29.07.2022 berichtet (siehe https://schaedlings.net/fachwissen/newsletter-artikel/abgehorcht-knabbert-da-wer/). Mit Hilfe eines mobilen Messgeräts mit Sensor und entsprechender Software wurde nachgewiesen, dass die Körperschallemission aktiver Insektenlarven visualisierbar gemacht werden kann (Becker et al. 2020). In der Vergangenheit wurde bereits mehrfach versucht, die Geräusche von fressenden Larven im Holz zu detektieren. Die Pionierarbeit leistete Pallaske (1984). Schon länger im praktischen Einsatz ist der „Wood Worm Detector“ (Creemers 2012, 2015) Neben einem sogenannten „Bajuphon“ (mündl. Hinweis Plarre 2022) gab es weitere unterschiedliche Geräte, mit denen die Fraßgeräusche am Holz akustisch verstärkt wurden. Bei Larven vom Hausbock, die man teilweise schon ohne technische Hilfe hören kann, kann das funktionieren, bisher fehlte jedoch eine Technik zum Nachweis der teilweise nur wenige Millimeter großen Larven, wie z.B. Anobium punctatum oder Lyctus brunneus, im Holz. Deren Geräusche können nicht als Luftschall wahrgenommen, jedoch mit einem „elektronischen Stethoskop“ auch über längere Messzeitintervalle (Minuten bis Tage) registriert werden. Neben einem stationären Gerät für das Labor, liefert eine mobile Version auch gleichwertige Ergebnisse.
Erste Versuche mit der Detektion von Larven des Brotkäfers in Lebkuchen zeigten Erfolg. Siehe Vortrag von Querner/Biebl auf dem IADA Kongress 2023.
Weitere Informationen und Literatur über die Homepage IADS
Identifikation
Wichtige Museumsschädlinge
Literatur Museumsschädlinge
Schädlingsbestimmung
Mikroskop, Ausrüstung zur Bestimmung
Informationen im Internet (Deutsch)
IPM in Museen Webseite von Dr. Pascal Querner aus Wien mit Publikationen und Links zu Firmen und Herstellern.
Consult Victoria IPM für Museen Webseite von Victoria Britten mit Informationen und Beratungsleistungen.
Forum Kulturbewahren Forum für Bewahrung, Pflege, Sicherheit und Präsentation von Kunst- und Kulturgut
SiLK – SicherheitsLeitfaden Kulturgut Informationsseite der Konferenz Nationaler Kultureinrichtungen mit Wissenspool und Literatur
Long Life for Art Webseite von Christoph Waller mit Didaktik zum Thema IPM und Produkte für Museen und Industrie
PCN Ausgaben | Pest Control News – Deutschland Verschiedene Berichte über Schädlingsbekämpfung und Schädlingsporträts. Ausgaben von 2008 bis 2022 zum Lesen und Downloaden (Zugriff 18.08.2022)
Panko Monitoring Traps Webseite der Firma Panko mit Informationen über IPM, Monitoring, Fallen (verschiedene Produkte)
Sächsische Landesstelle für Museumswesen (2020) Handreichungen für die Museumsarbeit, Bewahren und Erhalten von Sammlungsobjekten. Nr. 1 Schutz der Sammlungsbestände vor Schädlingen – Integriertes Schädlingsmanagement (IPM)
Informationen im Internet (Englisch)
www.museumpest.net Die amerikanische Vorlage für die deutsche Informationsseite Museumsschädlinge.de mit vielen Informationen über IPM, Bekämpfungsmethoden, Insektenbiologie, Literatur usw.
www.whatseatingyourcollection.com Die britische Homepage von Jane Thompson Webb und David Pinniger in Zusammenarbeit mit verschiedenen Institutionen. Informationen zu Diagnose und Lösungen, Fundnachweise von Insekten, IPM-Datensammlung und Literatur.
Pest Eradication Materials Database (PEMD) Risikobewertungstool von Ashley Bowersox für die Bewertung von befallenen Objekten. Als Masterarbeit in Zusammenarbeit mit dem FAIC
Introduction to Museum Pests Ein E-Learning-Tool vom Museum of London mit Schädlingen, Lösungen und Testfragen zum Thema IPM
FUNdamentals of Museum IPM. Eine Zusammenfassung von Christa Deacy-Quinn (collections manager) aus dem Jahr 2019 als Free-Book
Insectes du Patrimonie Culturel (CICRP) Eine Datenbank mit über 115 Arten von Insekten unseres Kulturerbes aus Frankreich
Insectes muséophages (OCIM) Eine französische Informationsseite zur Insektenbestimmung für Fachleute von Museen, Bibliotheken und Archiven ohne entomologische Kenntnisse
Pest Odyssey Die englische Informationsseite der Pest Odyssey UK group
www.english-heritage.org.uk Guidance notes and Fact sheet. Informationen über Museumsschädlinge, Kälteanwendung, ein Schädlingsposter und Monitoring Tools.
www.english-heritage.org.uk Forschung zu Kleidermotten in England (UK)
www.cultureelerfgoed.nl Buggy Biz: Integrated Pest Management in Collections. Netherlands Institute for Cultural Heritage (ICN) and IADA, Amsterdam
Pest Partners South West Museum Development mit Unterstützung von Historic England. Informationshomepage und Anleitungen zum Schädlingsmanagement mit hilfreiche Videos zur Installation von Monitoring-Fallen oder das Einfrieren von Objekten. Entwicklung eines Kartenspiels mit Museumsschädlingen, siehe Presse/Öffentlichkeit 2021.
ICUP Proceedings Verschiedene Beiträge zu den Internationalen Tagungen für Städtische Schädlinge (International Conference on Urban Pests), die seit 1993 bis 2017 alle 3 Jahre an verschiedenen Orten der Welt stattfinden (u.a. in England, USA, Singapur, Brasilien, Schweiz)
IWCSPP International Working Conference on Stored Product Protection Einzelne Beiträge zu Themen aus dem Museumsbereich oder Museumsschädlinge.
IBBS International Biodeterioration and Biodegradation Symposium Einzelne Beiträge zu Themen aus dem Museumsbereich oder Museumsschädlinge.
IOBC WPRS International organisation for Biological Control West Palaearctic Regional Section. Einzelne Beiträge zu Schädlingen und Methoden im Vorratsschutz und Museumswesen
ICOM-CC’s Triennial Conference / ICOM General Conferences Museum International Publikationen
Journal of Pest Science (Springer Link Online) Das Journal of Pest Science wird seit 1925 veröffentlicht und ist eine führende Fachzeitschrift, die sich allen Facetten der Schädlingsforschung widmet, einschließlich der Forschung in den Bereichen Landwirtschaft, Gartenbau, Forstwirtschaft, städtische Schädlinge und Vorratsschutz.
International Journal of Pest Management (Taylor & Francis Online) Forschungsarbeiten und Übersichtsarbeiten, die sich mit der Schädlingsbekämpfung im weiteren Sinne befassen. Wirbellose, Wirbeltiere, Unkräuter, – einschließlich biologischer Bekämpfung
Insects Limited Beratung, Forschung & Entwicklung und Verkauf von Pheromonen & Fallensystemen aus USA. Veranstalter der international bekannten Konferenzen Fumigants & Pheromones und langjähriger Herausgeber informativer Newsletter.
Inhaltsverzeichnis
Übersicht der verschiedenen Themen und Link über die Titel
Hinweis: Stichwörter können über die Funktion SUCHE (braunes Feld unten rechts) eingegeben werden.
(weiterlesen…)Insektenbestimmung
Hier finden Sie Fachbücher, Online-Bestimmungshilfen und Datenbanken zur Biodiversität sowie Hinweise auf spezialisierte Fachleute
(weiterlesen…)Insektenfallen Tabelle
Häufig vorkommenden Museumsschädlinge und die am Markt verfügbaren und geeigneten Überwachungssysteme (Fallen);
L= Larve, K= Käfer, Nummer (siehe Legende)
| Schädlingsart | Klebefalle | Pheromon | Fraßlockstoff | Lichtfalle | Gelbtafel |
|---|---|---|---|---|---|
| Käfer | |||||
| Museumskäfer (Anthrenus museorum) | + L, K | + L | + K | ||
| Polsterwarenkäfer (Anthrenus flavipes) | + L, K | (+) | + L | + K | |
| Wollkrautblütenkäfer (Anthrenus verbasci) | + L, K | + (4) | + L (1+2) | + K | |
| Australischer Teppichkäfer (Anthrenocerus australis) | + L, K | + L | + K | ||
| Brauner Pelzkäfer (Attagenus smirnovi) | + L, K | + | + L | + K | |
| Dunkler Pelzkäfer (Attagenus unicolor) | + L, K | + 4+5 | + L (1+2) | + K | |
| Pelzkäfer (Attagenus spp.) | + L, K | + L (1+2) | + K | ||
| Gemeiner Speckkäfer (Dermestes lardarius) | + L, K | + L (1+2) | + K | ||
| Speckkäfer (Dermestes spp.) | + L, K | + L (1+2) | + K | ||
| Berlinkäfer (Trogoderma angustum) | +L, K | + K | |||
| Khapra-Käfer (Trogoderma granarium) | + L, K | + K | + (3) | + K | |
| Odd Beetle Thylodrias contractus | + L, K | ||||
| Kugelkäfer (Gibbium psylloides) | + K | ||||
| Messingkäfer (Niptus hololeucus) | + K | ||||
| Diebskäfer sp. | + K | ||||
| Moderkäfer (z.B. Latridiidae) | + K | ||||
| Brotkäfer (Stegobium paniceum) | + K | + K | + | + K | + K |
| Tabakkäfer (Lasioderma serricorne) | + K | + K | + L (3) | + K | + K |
| Holzschädlinge | |||||
| Splintholzkäfer (Lyctus spp.) | + K | + K | |||
| Gemeiner Nagekäfer (Anobium punctatum) | + K | + K | |||
| Motten | |||||
| Kleidermotte (Tineola bisselliella) | + | + | |||
| Pelzmotte (Tinea pellionella) | + | + | |||
| Fellmotte (Monopis spp.) | + | + | |||
| Dörrobstmotte (Plodia Interpunctella) | + | + | |||
| Kleistermotte (Endrosis sarcitrella) | + | + | |||
| andere Insekten | |||||
| Fliegen (Diptera spp.) | + | + | + | ||
| Schaben (Blattella/Blatta spp.) | + | + | |||
| Papierfischchen (Ctenolepisma longicaudata) | + | + | |||
| Silberfischchen (Lepisma saccarina) | + | + | |||
| Staubläuse (Psocoptera) | + | ||||
| Ameisen (z.B. Lasius spp.) | + | + | geflügelte Tiere | ||
| Spinnen, Asseln, Laufkäfer, Tausendfüßer, Hundertfüßer, | + | + |
Legende:
1 = Dermestid larval monitor (Ködertablette für Larven)
2 = Dermestid beetle Kit (Ködertablette für Käfer und Larven)
3 = Gel Attractant (Gel-Köder)
4 = AA Carpet beetle Lure (Doppelpheromon-Dispenser mit 6 Pheromonen
und Kairomone für Attagenus und Anthrenus-Käfer)
5 = Black Carpet Beetle Lure (Pheromon für Dunkler Pelzkäfer)
Literatur
Biebl (2018) Museumsschädlingen auf der Spur. Monitoring von Insekten und Schadnagern in Kultureinrichtungen, Restauro 2, S. 30–37.
Monitoring – Pheromone Tips | Museumpests.net
The Pherobase Database of pheromones and semiochemicals. Datenbank und Literatur Zugriff 27.01.2021
Insektizide / Biozide
Chemikalien in gasförmiger, flüssiger, fester oder pulverförmiger Zusammensetzung zur Insektenbekämpfung
(weiterlesen…)Inspektion: wie und wo sucht man nach Schädlingen
Bei der Inspektion (Monitoring) ist neben den Sammlungsgütern auch auf Spuren von Schadinsekten oder Nagern zu achten, die man in Räumen finden kann. Da manche Insekten nachtaktiv sind oder sich als passives Stadium (Larve, Puppe) gut versteckt halten, ist gezielt zu suchen. Das Mitführen einer Lampe (Lichtquelle) beim Absuchen von dunklen Stellen (z.B. Ritzen, Fugen, Hohlräume) ist grundsätzlich wichtig!
(weiterlesen…)Invasive Schadinsekten
Einschleppung fremder Arten nach Europa
Als invasive Arten gelten Tiere oder Pflanzen dann, wenn sie sich in einem neuen Umfeld ausbreiten und sich dies wiederum auf heimische Arten auswirkt. Heimische Insekten können durch fremde Arten verdrängt werden, wie es beim Beispiel Asiatischer Marienkäfer bekannt ist. Ähnliches kann man bei den Fischchen in Gebäuden feststellen, wo das Silberfischchen in vielen Bereichen durch das Papierfischchen oder Geisterfischchen zunehmend verdrängt wird.
Die Einschleppung von exotischen oder fremdartigen Holzschädlingen, wie Bohrkäfer, Splintholzkäfer oder Termiten im Rahmen von Ausstellungen oder Sonderausstellungen in Museen kann immer wieder beobachtet werden. Neben den Kunstwerken können auch verschiedene Materialien aus der zusätzlichen Ausstellungsdekoration durch Schädlinge befallen sein.
Überblick über relevante invasive Tierarten
- Ameisen
- Termiten
- Käfer
- Wanzen
- Fischchen
- Mücken
Literatur
Körber, I., Teuber, K., Pospischil, R., Sellenschlo, U. und H. Fänger (2012): Vorläufige Liste der für die
Schädlingsbekämpfung wichtigen Neozoen in Deutschland. Pest Control News, 51: 28 – 29
Landsberger B. (2022) Fakultativ materialschädigende und invasive Schadinsekten in den Sammlungen der Staatlichen Museen zu Berlin, In: Berliner Beiträge zur Archäometrie, Kunsttechnologie und Konservierungswissenschaften (BBA), Band 23, S. 119-125
Pinniger, D. B. (2001) New pests for old: the changing status of museum pests in the UK. In: Kingsley, H. et al. (Eds.) Integrated Pest Management for collections. Proceedings of 2001 – a pest odyssey. (James and James) London, 2001. 9-13
Pospischil, R. (2014) Invading species: a challenge for pest management. In: Proceedings of the Eighth International Conference on Urban Pests. Gabi Müller, Reiner Pospischil and William H Robinson (Eds.) 2014, Zürich, 303 – 308
Schmidt M. (2022) Invasiver Käfer frei Haus. DpS 07+08, S. 12
Sellenschlo, U. (1986) Nachweis des Nordamerikanischen Wespenkäfers Reesa vespulae (Col., Dermestidae) in der Bundesrepublik Deutschland. Neue Ent. Nachr., 19(1/2): 43 – 46
Pospischil (?) Käfer im MMK Frankfurt
Kältebehandlung
Insektenbekämpfung mit niedriger Temperatur (-20 bis -40 Grad Celsius)
(weiterlesen…)Klebebänder
Mechanische Barrieren zum Fangen und Kontrollieren von laufenden Insekten
(weiterlesen…)Klebefallen mit zusätzlichem Pheromon
Insektenklebefallen, die mit einem separaten Pheromon bestückt werden
(weiterlesen…)Lagerung im Depot
Der Schutz von Objekten vor Schädlingsbefall setzt ein dichtes Gebäude, eine übersichtliche Lagerung, regelmäßige Reinigung und Überwachung von Insekten und des Klimas voraus.
Innerhalb von Depoträumen können Vitrinen oder dicht schließende Schränke eine zweite Barriere gegenüber Schädlingsbefall darstellen. Dies betrifft kriechende oder auch fliegende Insekten, wie z.B. Papierfischchen oder Kleidermotten.

Eine überschaubare Lagerung und Zugänglichkeit erleichtert die Kontrolle an den Objekten auf mögliche Spuren von Schädlingsbefall. Helle Untergründe bei Böden oder in Regalen sind je nach Art und Spuren von Museumsschädlingen von Vorteil.
Die Absenkung der Raumtemperatur im Depot auf unter 20°C ist nicht nur entwicklungshemmend für Insekten oder Schimmelpilze, sondern auch besser für den Energieverbrauch. Stichwort „Grüne Museen„. Hier ist speziell auch die Depotplanung gefragt, wenn es um neue Zentraldepots oder Sanierungen von alten Depotgebäuden geht. Im Museumsbereich gibt es spezialisierte Fachplaner/innen für Depots, die bei der Planung oder Neukonzeption zu Rate gezogen werden können.
Die Reinigung in Depot- oder Archivräumen wird durch gute Lagerung (Logistik) und Nutzung von Regalen vereinfacht. Das Abstellen von Kartonagen oder Paletten am Boden oder entlang von Wänden führt häufig zu Problemen bei der Unterhaltsreinigung.
Im Rahmen einer Inventarisierung von Exponaten kann auch das Thema Deakzession (Entsammeln von Museumsobjekten) eine positive Rolle bei der (Über-)Lagerung im Depot spielen, wenn gefährdete Objekte in doppelter Menge vorhanden sind. Dies kann auch zur Prävention von Schädlingsbefall in Depoträumen helfen.
Beim Auffinden von verdächtigen Objekten mit beispielsweise Bohrmehl oder Tierexkrementen sollten diese in einen Quarantäneraum verbracht oder können einzeln separiert werden. Siehe Quarantäne.

Ausreichender Abstand vom Regal zum Boden ermöglicht bessere Kontrollen.
Die Holzleiste im Bild ist hinderlich bei der Reinigung

Frei gelagerte Holzexponate und leicht erkennbarer Insektenbefall (Nagekäfer) im Depot.

Offene Kabeldurchführungen durch Innenwände stellen undichte Übergänge zwischen Depoträumen dar.
Literatur
Axer P. und Pelludat I. (2004) Kunst und Antiquitäten. Empfehlungen zur Handhabung, Reinigung und Aufbewahrung. Verlag Schnell+Steiner. 109 Seiten
Baur J. (2018) Die hohe Lagerdichte war eine Herausforderung. In: Restauro 5, S. 16-17. Pressemeldungen Zugriff am 15.08.2021
Biebl S. & Querner P. (2020) Transportation of Wood Boring Beetles in Wooden Transport Boxes, Wooden Pallets, and Newly Bought Wood in Museums, Studies in Conservation, 66:1, 44-50
Brimblecombe, P., M.-C. Pachler and P. Querner. (2021) Effect of Indoor Climate and Habitat Change on Museum Insects during COVID-19 Closures. Heritage 4, 3497-3506
Fuger W. und Kreiliger K. (1998) Das Museumsdepot, Grundlagen – Erfahrungen – Beispiele. Landesstelle für die nichtstaatlichen Museen in Bayern (Hg.) Band 4, Weltkunstverlag. 286 Seiten
Holl K. und Kilian R. (2022) Handbuch Depots und Archive. Handlungsempfehlungen für Planung und Betrieb. Fraunhofer IRB. 216 Seiten
Kobold M. und Moczarski J. (2020) Die Lagerung. Erschienen in: Bestandserhaltung: Ein Ratgeber für Verwaltungen, Bibliotheken und Archive. 3. Auflage. S. 60-140. (Zugriff am 05.04.2021)
Piening H. (1999) Das Depot im Depot: Gasdichte Klimazelte für Notlagerungen, Restauro, 105, Heft 4, S. 286-287
Prevart (Zugriff am 15.08.2021) verschiedene Informationen über den Link Depotplanung
Wießmann A. und Stäbler W. (2014) Gut aufgehoben. Museumdepots planen und betreiben. Landesstelle für die nichtstaatlichen Museen in Bayern (Hg.) Band 16, Deutscher Kunstverlag. 287 Seiten
Lebendfallen
Falle zum Monitoring und Fangen von Fischchen oder anderen Insekten
Eine gute Möglichkeit Papierfischchen zu fangen, ist die vom Rathgen-Forschungslabor entwickelte Papphülse mit Kunststoffdeckel (Landsberger und Querner 2017), die bereits in vielen Museen oder Archiven als Lebendfalle im Einsatz ist. Da Papierfischchen häufig vertikale Oberflächen (Putz- oder Rigipswände) emporklettern, gelangen die Tiere auch über den Karton der Lebendfalle in den Deckel (siehe Foto unten). Durch die glatte Oberfläche und vorgegebene Tiefe des Deckels sind die Papierfischchen nicht mehr in der Lage zu entfliehen.
Der Einsatz von zusätzlichen Lockstoffen, wie z.B. konventionelle Frassköder-Tabletten (siehe Foto unten), Trockenfutter für Katzen oder Fische, stärkehaltiges Papier o.ä. im Deckel, kann die Fangergebnisse in gewissen Maße erhöhen, ist aber nicht zwingend notwendig. Die gefangenen lebenden oder abgestorbenen Tiere sollten regelmäßig aus dem Deckel entfernt werden.
Aufgrund von Praxis-Erfahrungen mit nicht ausreichend glatten Kunststoffdeckeln, bei denen gefangene Papierfischchen wieder flüchten konnten, wurden als 2te Lebendfallen-Generation glatte Metalldeckel seitens Hersteller eingeführt.
Neben Papierfischchen konnten bisher auch Ameisen, Bodenwanzen oder Käfer in den Deckeln von Lebendfallen gefunden werden.

Papphülsen 20cm/10cm hoch und Durchmesser 10cm mit Metalldeckel (lose)

Papphülse 20cm hoch mit Kunststoffdeckel (lose)
Hinweis: Kunststoffdeckel sind nicht mehr erhältlich!

Gefangene Papierfischchen in Kunststoffdeckel, ohne Köder!!

Gefangene Papierfischchen in Kunststoffdeckel, mit Köder

Gefangene Insekten (u.a. Bodenwanze) in Kunststoffdeckel
Empfehlungen zur Nutzung von Lebendfallen, nach Dressen (2022)
- Die idealen Standorte für diese Fallen sind entlang von Wänden oder in Ecken.
- Lebendfallen sollten alle zwei bis vier Wochen gereinigt werden.
- Spinnennetze sollten sowohl aus der Falle und ihrer Umgebung entfernt werden, um zu verhindern, dass gefangene Tiere aus dem Deckel entkommen können.
- Köder sollten alle zwei bis vier Wochen ersetzt werden, um eine möglichst hohe Anziehungskraft auf Papierfischchen zu gewährleisten.
- Die Lebendfallen sollten mit einem Lineal o.ä. ausgestattet sein, mit dem man später die Größe des einzelnen Insekts mit Hilfe eines Fotobearbeitungsprogramms dokumentieren kann.
Literatur
Biebl S. (2018) Museumsschädlingen auf der Spur. Monitoring von Insekten und Schadnagern in Kultureinrichtungen. RESTAURO, Ausgabe 2, S.30-37
Dressen C. (2022) The detection of grey silverfish (Ctenolepisma longicaudatum Escherich, 1905) in the Museum of Applied Art, Frankfurt/Main. In: S. Ryder and A. Crossmann (eds), Integrated Pest Management for Collections. Proceedings of 2021: A Pest Odyssey, The Next Generation. Archetype Publications. 43-48
Landsberger B., Querner P. (2017) Neuer Materialschädling in der Kulturlandschaft, Papierfischchen breiten sich in Museen und Depots aus, Restauro 2/2017, S. 14-18
Lichtfallen
Elektronische oder mechanische Lichtfallen mit Klebeflächen zum Fangen und Reduktion von fliegenden Insekten
(weiterlesen…)Literaturliste IPM
Auswahl verschiedener Literaturquellen zum Thema Integrierte Schädlingsbekämpfung (IPM), Schädlinge, Tagungsbände, Sammlungspflege, Schimmelpilze und Holzschutz
(weiterlesen…)Notfallplanung für akuten Schädlingsbefall
Erste Hilfsmaßnahmen im Notfall zur Vermeidung von Schäden
(weiterlesen…)Pheromone
Populations-Reduzierung oder Verwirrtechnik (mating disruption)

Populations-Reduzierung
Durch das Abfangen von männlichen Mottenfaltern mit Pheromon- bestückten Fallen (z.B. mit Klebefläche oder Trichterfalle) ist eine gewisse Populations-Reduzierung bei starkem Befall möglich. Eine Bekämpfung ergibt sich aber daraus nicht, da keine weiblichen Motten gefangen werden können, die nach der Paarung pro Tier bis zu 200 Eier an Textilien ablegen können.

Männliche Kleidermottenfalter auf einer Pheromonfalle
Verwirrtechnik (mating disruption)
Mit hochdosierten artspezifischen Pheromonen, die in Tabletten aus einem lebensmittelechten Pulver (Entostat) gebunden sind, können männliche Mottenfalter angelockt und bei Kontakt elektrostatisch bestäubt werden. Die mit weiblichen Pheromonen bestäubten Männchen werden bei der weiteren Paarungssuche gestört bzw. verwirrt, da ihre Pheromonrezeptoren überlastet sind. Diese Methode wurde 2011 von der Firma Exosect als patentierte Verwirrtechnik (Auto-Confusion-System) mit dem Produkt „ExoSex SPTab“ in Deutschland auf den Markt gebracht. Neben blauen Pheromon-Dispensern für Lebensmittelmotten (Plodia/Ephestia) wurden auch transparente Dispenser mit Pheromonen für die Kleidermotte (Tineola bisselliella) entwickelt. Praktische Versuche in Museen mit Kleidermottenbefall wurden in England (English Heritage), Deutschland und Österreich (Eigentests von den Verfassern) durchgeführt. Daten über längerfristige Erfolge fehlen aber bislang noch (Pinniger et al. 2016).

Dispenser mit Pheromon-Tablette zum Anlocken von männlichen Kleidermotten-Faltern in einem Museum
Literatur
Biebl S. (2013) Nützlinge gegen Kleidermotten. Praktische Erfahrungen im Deutschen Museum München. Restauro 1. S. 39-41
Biebl S. (2009) Deutsches Museum: Nützlinge gegen Kleidermotten, Der praktische Schädlingsbekämpfer Ausgabe 03, Seite 14-15
Higgs S. / Bridal J. (2011) Moths, Exosex and floor voids at Hampton Court Palace. In: Windsor, P. et al. (Hg.), Integrated Pest Management for Collections, Proceedings of 2011: A Pest Odyssey, 10 Years Later. English Heritage, Swindon: 61-65
Karg G. (2006) Mottenkontrolle durch Paarungsstörung. Der praktische Schädlingsbekämpfer (DpS) 11. S.10-11
Lachmuth U. (2011) Verwirrtechnik (mating disruption) im Museum. Ein neuer Ansatz zum Schutz von Textilien und naturwissenschaftlichen Exponaten vor Mottenbefall. In: Beiträge zur Erhaltung von Kunst- und Kulturgut. VDR Heft 2, S. 116-117
Lauder D. (2011) The Exosex clothes moth system and English Heritage. In: Windsor, P. et al. (Hg.), Integrated Pest Management for Collections, Proceedings of 2011: A Pest Odyssey, 10 Years Later. English Heritage, Swindon: 204
Pinninger et al. (2016) Handbuch Integriertes Schädlingsmanagement in Museen, Archiven und historischen Gebäuden, Gebr. Mann Verlag Berlin. Seite 96
Pinniger D. (2011) New developments in pest management for collections in museums and historic houses. In: Proceedings of the Seventh International Conference on Urban Pest . S. 17-21
Quarantäne (Isolieren)
Vermeidung einer Einschleppung oder Verbreitung von Schädlingen über Neuzugänge oder Leihgaben
(weiterlesen…)Reduzierung der Luftfeuchtigkeit
Reduzierung der Fortpflanzung von Insekten durch Veränderung der Luftfeuchte
(weiterlesen…)Repellentien
Substanzen, die der Abwehr von Schädlingen oder Lästlingen dienen
Die Abwehr von Mücken mit dampfförmigen Stoffen (z.B. Mückenspirale mit insektizidem Wirkstoff) oder repellierenden Substanzen (z.B. ätherische Öle) ist allgemein bekannt. Der Auftrag von Wirkstoffen, wie DEET, Icaridin und IR 3553 auf die menschliche Haut dient zur Vermeidung von stechenden Insekten wie Zecken oder Mücken. Natürliche Duftpflanzen, wie Patchouli-Kraut, Heiligenkraut oder Weißer Salbei werden in der Volksheilkunde zum Auslegen oder als Zutat im Räucherwerk zur Abwehr von Motten, Mücken oder gegen Schädlingsbefall benutzt.
Der Einsatz von chemischen oder natürlichen Substanzen zur Abwehr von Vögeln (z.B. verwilderte Haustauben) oder Wirbeltiere, wie z.B. Marder, Maulwurf oder Wildtiere wird mit Produkten aus dem Handel beworben.
Zur natürlichen Abwehr von Textilschädlingen, wie Kleidermotten oder Pelzkäfern, werden Produkte wie Steinkleekraut, Lavendel, Orange, Patchouli-Kraut oder -Öl, Teebaumöl, Zedernholz, Thymian, Kampfer usw. handelsüblich angeboten und seit vielen Jahren in Textil-Sammlungen verwendet. Die leicht flüchtigen Substanzen wie Paradichlorbenzol, Naphthalin und Kampfer weisen eine sehr geringe Insektentoxizität auf, aber wurden früher häufig zur Abwehr von Insekten eingesetzt (Medha et al 2021)
Die Wirkung von ätherischen Ölen, wie Nelkenöl in Kombination mit Citral oder Citronellol parfümiert mit Lavendelöl zeigte nach wissenschaftlichen Laboruntersuchungen eine Wirkung zum Schutz gegen den Zuflug von Kleidermotten. Nach längeren Versuchszeiten zeigten sich allerdings verstärkte Fraßschäden durch Kleidermottenlarven an Wollstoffen, da eine Eiablage der Weibchen trotz repellierender Substanzen erfolgte (Plarre et al 1997)
FAZIT: Aufgrund wissenschaftlicher Untersuchungen und praktischer Erfahrungen hat sich erwiesen, dass es keine repellierenden Substanz(en) gibt, die einen sicheren Schutz gegenüber Schadinsekten im Museum gewährleisten und zeitgleich kein Risiko für die Objekte oder den menschlichen Anwender darstellen. Aus der Möbelrestaurierung ist beispielsweise bekannt, dass ätherische Öle gute Lösemittel für Lacke und Firnisse sein können.
Aufgrund gesetzlicher Bestimmungen und Verordnungen dürfen biozide Stoffe oder Zubereitungen in der europäischen Union nicht mehr verwendet oder in Verkehr gebracht werden. So gilt die Anwendung von „Mottenkugeln“ mit den Wirkstoffen Naphtalin oder Paradichlorbenzol aus heutiger Sicht als gesundheitsschädlich und umweltgefährdend.
Einzelne Fälle zeigten zudem, dass trotz Einsatz von „Mottenkugeln“ ein Schädlingsbefall mit beispielsweise Kleidermotten weiterhin aktiv vorhanden war.
Zusätzlich ist zu erwähnen, dass Repellentien aus Pflanzenteilen unter Umständen von spezialisierten Insekten als Nahrungsgrundlage genutzt werden können. So sind die Larven des Tabakkäfers in der Lage, sich trotz des schädlichen „Nikotins“, von Tabaksamen oder Tabakprodukten zu ernähren. Aber auch der Befall an pflanzlichen Repellentien in Textil-Depots durch die Larven von Lebensmittelmotten wurde beobachtet.
Neben dem Einsatz von Repellentien kamen in der Vergangenheit auch chemische Biozide zum Einsatz, die als Rückstände (siehe Tabelle Übersicht Insektizide) noch gesundheitsschädlich sein können und trotzdem ein Insektenbefall an Textilien, Leder oder Holz vorkommen kann.

Häufig werden oder wurden Textilien in Sammlungs-Kartons mit repellierenden Substanzen gegen Kleidermottenbefall bestückt.

Lavendel zur Abwehr von Kleidermottenfaltern in einem Textildepot

Paradichlorbenzol-Granulat zur Insektenabwehr in einer Museums-Vitrine
Literatur
Detmers H.B., Wohlgemuth R., Schneider E. (1992) Über die Wirkung von Steinkleekraut und Patschuligranulat auf die Kleidermotte Tineola bisselliella Hum. (Lepidoptera: Tineidae) Anz. für Schädlingskde. Pflanzenschutz, Umweltschutz 65 (5), 81-88
Medha K. et al (2021) A comprehensive review on moth repellent finishing of woolen textiles. Journal of Cultural Heritage Vol. 49, 260-271
Plarre R. et al (1997) Effects of oil of cloves and citronellol, two commercially available repelltens, against the webbing clothes moth Tineola bisselliella Hum. (Lepidoptera: Tineidae). Anz. für Schädlingskde. Pflanzenschutz, Umweltschutz 70, 45-50
Plarre R (1992) Repellent-Wirkung von Nelkenöl und Citral auf die Kleidermotte, Mitt. deutsch. Phytomed. Ges. e.V. 3 (22), 24-25
Prozell S., Borchert M (1989) Untersuchungen über die insektzide Wirkung ätherische Öle, Diplomarbeit am FB Biologie der Freien Universität Berlin, 154 S.
Shaaya E, Kostyukovsky M (2006) Essential oils: potency against stored product insects and mode of action. Steward Postharvest Rev 2 (4)
Umweltbundesamt Repellentien und Lockmittel Zugriff am 14.03.2021
Schäden durch chemische oder physikalische Behandlungen
Pestizide in der Vergangenheit und alternative Verfahren heute
In der Vergangenheit wurden hochgiftige Gase und Pestizide zur Schädlingsbekämpfung in Museen, Archiven oder Sammlungen eingesetzt (Tello 2018 und 2022). So waren in Deutschland im Zeitraum 1925 bis 1935 insektizide Begasungsmittel wie Ethylenoxid mit Kohlendioxid (T-Gas) oder Blausäure (Zyklon B) gegen Schadinsekten im Einsatz. Als erster Vertreter der pulverisierten Insektizide kam DDT-Staub zum Einsatz, der bis heute noch Probleme in alten Gebäuden mit sich bringen kann. Die Rückstände von DDT können sich auch in historischen Bibliotheken wiederfinden, wenn dort gegen Schädlinge vorgegangen wurde. Die Imprägnierungsmittel Eulan und Globol galten 1965 als zugelassene Mittel gegen Woll- und Pelzschädlinge gemäß dem Vorratsschutzmittel-Verzeichnis der Biologischen Bundesanstalt Braunschweig. In den Jahren 1980 bis 1997 folgte das Begasungsmittel Brommethan der Zyklon-Blausäure und wurde ab 1997 durch den noch heute zugelassenen gasförmigen Holzschutzmittel-Wirkstoff Sulfuryldifluorid (Vikane) abgelöst.



Auch in der Gegenwart können bei Anwendung von chemischen Produkten oder beim Einsatz von alternativer Verfahren mit physikalischer Wirkung mögliche Veränderungen oder Schäden an Objekten oder Gebäuden entstehen. Unter Umständen passiert dies mit fehlender Fachkenntnis und Erfahrung oder mangelhafter Technik.
Beispiele aus der Praxis und Wissenschaft
- Korrosion von Metallgegenständen und Legierungen durch Phosphin / Phosphorwasserstoff (Gas)
- Farbänderungen an Tönungen und Malereien durch Cyanwasserstoff (Gas) in Kirchen
- Materialveränderung (schwefelhaltige Materialien, Leder, Pergament, tierische Leime, polierte Metalloberflächen und Bleipigmente durch Brommethan (Gas)
- Abnahme der Zugfestigkeit von Seide und Zellulosematerialien durch Ethylenoxid (Gas)
- Verschlechterung der mechanischen Eigenschaften bei Textilien durch Gammastrahlung
- Sulfuryldifluorid (Gas) kann Korrosion verursachen.
- Einwirkung auf Pigmente und Bindemittel durch Kohlensäure bei einer Kohlendioxidbegasung bei erhöhter Luftfeuchte
- Schädigende Wirkung auf DNA durch reaktive Begasungsmittel
- Negative Beeinflussung von DNA durch den Wirkstoff Dichlorvos (nicht mehr zulässiges Biozid, das früher häufig in Insektensammlungen eingesetzt wurde)
- Risiko einer Schädigung durch chemische Rückstände oder reaktive Lösemittel (z. B. Alkane/Kohlenwasserstoffe) durch Sprüh- oder Nebelmittel von konventionellen Schädlingsbekämpfungsprodukten.
- Mögliche Verschlechterung der Zugfestigkeit bei Seidenstoffen durch das feuchtegeregelte Warmluftverfahren
- Auswirkungen bei hohen Temperaturen auf die DNA in entomologischen Sammlungen
- Freisetzen von Geruchstoffen bei getrockneten Pflanzen (Herbarien) durch das feuchtegeregelte Warmluftverfahren.
- Schwundrisse an gefassten Holzoberflächen (z.B. Möbel) bei fehlender Befeuchtung während einer Anoxia-Behandlung mit Temperierung.
- Schädliche Wirkung von fungizidem Thymol (IUPAC: 5-methyl-2-isopropyl-1-phenol) auf Papierträger, Gummiarabikum und Eisengallustinte.
- Verfärbungen an Elfenbein durch Schwefeldioxid (SO2) im Laborversuch

Farbveränderung an Methylblau auf Trägerstoff nach Ozon-Behandlung (unveröffentlichter Versuch, HAWK Hildesheim 2023)
Schädlingsbefall in kontaminierten Sammlungen
In der Praxis können auch Schadinsekten in Sammlungen mit schadstoffbelasteten Objekten auftreten. So wurde in der Vergangenheit aktiver Kleidermottenbefall in Depoträumen mit volkskundlichen Textilien oder historischen Reitzubehör festgestellt, in denen insektizide Rückstände von z.B. DDT, 1,4-Dichlorbenzol oder Naphthalin nachgewiesen wurden. Oder auch lebender Nagekäferbefall am Holz von Gebäuden in Freilichtmuseen, die mit hohen Rückständen von chemischen Holzschutzmitteln wie Lindan und PCP belastet sind. Diese Fälle zeigen, dass ein langfristiger Schutz durch chemische Schädlingsbekämpfungsmittel an Museumsexponaten nicht gewährleistet werden kann. Der Einsatz von rückstandsfreien Verfahren sollte im Sinne der Integrierten Schädlingsmanagements bevorzugt werden, um Objekte, Mensch und Umwelt vor negativen Einflüssen von chemischen Pestiziden zu schützen.
Alternative Verfahren sind die Anwendung von mechanischen, physikalischen oder biologischen Methoden, die im Europäischen Standard DIN EN 16790 enthalten sind.
Literatur
Ackery PR, Testa JM, Ready PD, Doyle AM, Pinniger DB (2004) Effects of high temperature pest eradication on DNA in entomological collections. Stud Conserv, 49: 35-40
Ertelt P. (1993) Untersuchungen über kontrollierte Wärmebehandlung bei schädlingsbefallenem Holz, Diplomarbeit, Institut für Holzforschung Fachhochschule Rosenheim
Espeland et al (2010) Dichlorvos exposure impedes extraction and amplification of DNA from insects in museum collections. Frontiers in Zoology 7:2
Grosser D, Rossmann E (1974) Blausäuregas als bekämpfendes Holzschutzmittel für Kunstobjekte. Holz als Roh- und Werkstoff 32: 108-114
Gutarowska B et al (2016) Historical textiles – a review of microbial deterioration analysis and disinfection methods. Textile Research Journal 0(00) 1-19
Hahn O. (1999) Chemische Schädlingsbekämpfung. Risiken für Pigmente und Farbstoffe. Restauro 105 (4): 275-279
Hennen I. et al (2024) Schimmelbefall an Kirchenorgeln. Ein Indikator für bauphysikalische Probleme. Bausubstanz 1/2024, 26-33
Isbell L. (1997) The Effects of Thymol on Paper, Pigments and Media, The Abbey Newsletter vol. 21, n. 3, p. 39-43
Homolka M. (2015) Eulan – ein Biozid gegen Keratin-Schädlinge
und seine Relevanz in musealen Sammlungen. Teil II Lexikalischer Produktschlüssel nach Wirkstoffgruppen sortiert. Hg.: Stiftung Deutsches Historisches Museum. 122 Seiten.
Kigawa, R. and T.J.K. Strang (2011) ‘Effects of Fumigants and Non-Chemical Treatments on DNA Molecules and Proteins: Case Studies on Natural History Specimens and Proteinaceous Components of Museum Objects’, Integrated Pest Management for Collections: Proceedings of 2011:
A Pest Odyssey, 10 Years Later. Swindon: English Heritage, 115-122
Koestler R.J., Parreira E., Santoro E.D. (1993) Visual effects of selected biocides on easel painting materials. Studies in Conservation 38. 265-273
Piening H. (1993) Die Bekämpfung holzzerstörender Insekten mit Kohlendioxid sowie die Verträglichkeit des Gases an gefassten Objekten. Diplomarbeit Köln
Pinninger, D. / Landsberger B. / Meyer A. / Querner P. 2016. Handbuch Integriertes Schädlingsmanagement in Museen, Archiven und historischen Gebäuden, Gebr. Mann Verlag Berlin
Strang TJK (1996) The Effect of Thermal Methods of Pest Control on Museum Collections. Preprints of the 3rd International Conference on Biodeterioration of Cultural Property: 4-7 July, 1995; Bangkok, Thailand 199-212.
Tello H. (2022) Schädlingsbekämpfung in Museen. Wirkstoffe und Methoden am Beispiel des Ethnologischen Museums Berlin 1887 – 1936.
Tello H. (2018) Handle with Care – Über den Einsatz historischer Biozide in musealen Sammlungen. In: Tagung Schadstoffe Beiträge gesamt vom 16. 04. 2018, Deutscher Museumsbund, Leipzig. Online unter https://www.museumsbund.de/fachgruppen-und-arbeitskreise/arbeitskreis-konservierung-restaurierung/beitraege-zur-schadstofftagung-als-pdf/, S. 11 – 20. Zuletzt aufgerufen 08. 05. 2018.
Unger, A., Schniewind, A.P., Unger, W. (2001) Conservation of Wood Artifacts. Springer Verlag Berlin, Heidelberg. 578 Seiten
Unger W, Bischoff J, Fielitz L (1984) Zum Einsatz von Phosphorwasserstoff gegen holzzerstörende Insekten in denkmalgeschützten Gebauden. Holztechnologie 25(5):229-232
Schädlingen den Zugang erschweren
Gebäude können sehr unterschiedliche Umgebungen oder Bauweisen haben, die es Insekten anderen Tieren ermöglichen, in die Ausstellungs- oder Lagerräume (Depots) einzudringen.
Nachfolgende Beispiele zeigen die möglichen Eintrittspforten, die an historischen oder modernen Gebäuden vorhanden sein können:
PROBLEME

Historische Fenster sind häufig undicht und ermöglichen Insekten das Eindringen in das Gebäude.

Türen oder Tore können Insekten oder Mäusen das Eindringen in das Gebäude ermöglichen.

Rolltore von Anlieferungen sind auf Dichtigkeit zu kontrollieren

Dachräume auf Eintrittsstellen von Nagern kontrollieren. Bild: Speicherdepot mit Loch in der Leichtbau-Wand.

Kellerräume mit offenen Kabelübergängen abdichten (Brandschutz beachten)
LÖSUNGEN
Insektenschutzgitter für Fenster (Foto folgt)

Insektenschutzgitter (V2A) für Kellerschächte

Bürstenleisten für Türen

Schutzgitter gegen (Tauben, Marder usw.)

Netze gegen Zuflug von Vögeln (Tauben)
Schadnager-Bekämpfung
Vermeidung von Schäden und Gesundheitsgefährdung durch Krankheitserreger von Nagetieren
(weiterlesen…)Sicherheitsvorkehrungen bei Anwesenheit von Bioziden

Als Fluch der Vergangenheit oder treffend benannt als „Büchse der Pandora“ gilt die Belastung von Exponaten in Museen oder historischen Gebäuden (z.B. Freilichtmuseen), wo in der Vergangenheit chemische Bekämpfungen (zum Teil mehrfach) durchgeführt und Kulturgüter, wie Holz oder Textilien mit chlororganischen Verbindungen, wie z.B. PCP, Lindan, DDT oder anderen Chemikalien behandelt wurden. In vielen Bibliotheken oder Kirchen gelten Oberflächen als kontaminiert, wie es aus Naturkundemuseen bei Tierpräparaten mit Arsen bekannt ist. Immer wieder kommt es auch zu einem Kleidermottenbefall an pestizidbelasteten Textilien oder Nagekäferbefall an holzschutzmittelbelasteten Gebäuden, wo man auf eine mögliche Resistenz der Schadinsekten über längere Zeit-Epochen zurückführen kann. Siehe auch Thema „Schädlingsbefall in kontaminierten Sammlungen“ unter Schäden durch chemische oder physikalische Behandlungen. Aus diesem Grund wird in Museen, Archiven oder Bibliotheken bei der Schädlingsbekämpfung mittlerweile stark darauf geachtet, ohne chemische Wirkstoffe auszukommen.
Anzeichen von möglichen Pestizid-Rückständen sind Farbveränderungen, Kristalle, weißer Staub auf Objekten oder Oberflächen und in manchen Fällen wahrnehmbare Gerüche. In Gebäuden können an Dachstühlen unter Umständen alte „Dachkarten“ (Dokumentation gemäß DIN 68800-4) gefunden werden, die als Hinweis auf chemische Behandlungen mit flüssigen Holzschutzmitteln vor Ort dienen.
Rückstände von früheren Behandlungen können mit technischen Hilfsmitteln, wie mobile Röntgenfluoreszenz(RF)-Analysatoren oder mobile Raman- und FTIR-Spektroskopie für die In-situ-Messung von chemischen Wirkstoffen, in Sammlungen erfasst und gemessen werden. Staub- oder Raumluftproben können zur Analyse von Rückständen in Räumen ebenfalls genutzt werden.
13. Sept. 2020 Arbeitsausschuss – Arbeitssicherheit gegründet. Die Sensibilisierung auf Gefahrensituationen und bedenkliche Stoffe, Entwicklung von Handlungsanleitungen und Netzwerkbildung sind u.a. Themen, die die Vorsitzenden Dr. Boaz Paz (Chemiker) und Dirk Sturmfels (Restaurator) bearbeiten wollen. Quelle: VDR (Verband der Restauratoren)
1. Juni 2022: Startschuss für das Forschungsprojekt MUSA. MUSA – Innovative (Multi)-Methoden zum sicheren Umgang mit schädigenden Altbioziden. Gefördert wird dieses Projekt über einen Zeitraum von drei Jahren von der Deutschen Bundestiftung Umwelt (DBU). Das MUSA-Kernteam bestehend aus Dr. Elise Spiegel von Care for Art, Dr. Katharina Deering und Dr. Stefan Rakete vom LMU Klinikum sowie Carolin Wübbe von Ascora blicken den drei kommenden arbeitsintensiven Jahren erfreut entgegen
(weiterlesen…)Stickstoff als Biozid
Rückblick zu In-Situ-Stickstoff und Stand der Dinge für Deutschland und EU

Update für In-Situ-Stickstoff – 06. Mai 2024
Mit Wirkung von heute ist in situ generierter Stickstoff als Wirkstoff in Anhang I der Biozidverordnung aufgenommen. Damit steht nun einer langfristigen Produktzulassung in Deutschland mit anschließender vereinfachter Zulassung per Notifizierung in den anderen EU-Staaten nichts mehr im Wege. Mitteilung von Bill Landsberger Rathgen Forschungslabor, Berlin
Update für In-Situ-Stickstoff – 10.08.2023
Meldung vom 10.08.2023
Die nationale Zulassung der Verwendung von in-situ-generiertem Stickstoff im Kulturerbeschutz liegt als per Allgemeinverfügung vor. Aktenzeichen: 5.0-710 05/18.00037 und Zulassungsnummer: DE-0028887-18. Es gilt für berufsmäßige Verwender zur Bekämpfung von Schadorganismen in allen Bereichen des öffentlich institutionellen, privaten und kommerziellen Schutzes materiellen Kulturerbes. Diese Ausnahmegenehmigung für den Wirkstoff ist als Zulassung zunächst bis Ende 2024 befristet. Der deutsche Antrag zur permanenten Wirkstoffgenehmigung wird derzeit bei der Europäischen Chemikalienagentur noch bearbeitet und sollte rechtzeitig vor Ablauf der Frist entschieden sein, sodass die Produktzulassung dann lückenlos verstetigt werden kann. Mitteilung von Bill Landsberger Rathgen Forschungslabor, Berlin
Die Bundesstelle für Chemikalien gibt auf Ausnahmeantrag bekannt, dass in-situ hergestellter Stickstoff in Deutschland bis zum 31.Dezember 2024 wieder verwendet werden darf. Der Einsatz gilt zur Bekämpfung von Schadorganismen in allen Bereichen des öffentlich institutionellen, privaten und kommerziellen Schutzes materiellen Kulturerbes. Wenn in Folge zur Genehmigung ein Anhang-1-Antrag gestellt und genehmigt wird, kann eine weitere Verwendung von 10 Jahren möglich sein, laut Mitarbeiter Carsten Bloch der Bundesstelle für Chemikalien bei der Bundesanstalt für Arbeitsschutz und Arbeitsmedizin. Anschließend sei eine Verlängerung um 15 Jahre möglich und danach Praxis, dass die Zulassung für immer gelte.
Update für In-Situ-Stickstoff – 10.05.2023
..die Erteilung der Ausnahmegenehmigung für Stickstoff aus der Umgebungsluft verzögert sich erneut in Deutschland. Aufgrund einer internen Umstrukturierung der zuständigen Behörde mit Wechsel der zuständigen Personen, kommt es zu weiteren Verzögerungen bei der Zulassung von in-situ-Stickstoff. Aktueller Sachstand vom Rathgen-Forschungslabor
Update für In-Situ-Stickstoff 08.03.2023
Höhepunkte der BPC-Sitzung im März 2023
Der Ausschuss für Biozidprodukte (BPC) der ECHA (Europäische Chemikalienagentur) unterstützt die Zulassung von Stickstoff aus der Umgebungsluft als Wirkstoff mit geringem Risiko für Anhang I der Biozidprodukte-Verordnung (BPR).
Helsinki, 8. März 2023 – In seiner Märzsitzung hat der BPC zwei Stellungnahmen verabschiedet:
Unterstützung der Aufnahme von Stickstoff aus der Umgebungsluft in Anhang I der BPR. In Anhang I sind Wirkstoffe aufgeführt, die als wenig toxisch gelten und für eine vereinfachte Produktzulassung in Frage kommen. Die Europäische Kommission wird gemeinsam mit den EU-Mitgliedstaaten die endgültigen Entscheidungen über die Genehmigung von Wirkstoffen und die Unionszulassung von Biozidprodukten treffen.
***
Der Ausschuss tagte vom 1. bis 2. März 2023. Die angenommenen Stellungnahmen werden in Kürze auf der Website der ECHA veröffentlicht. Die nächste Sitzung findet im Juni 2023 statt. Hören Sie sich die Höhepunkte der Sitzung im Podcast an, in dem der Ausschussvorsitzende Erik van de Plassche seine Einschätzungen erklärt.
Quelle: https://lnkd.in/gjGTPhA7
UPDATE für In-Situ-Stickstoff – 07.02.2023
Meldung vom VDR Fachgruppe Präventive Konservierung zu In situ generierter Stickstoff: aktueller Stand.
UPDATE für In-Situ-Stickstoff – 12.12.2022
Die Ausnahmegenehmigung für insitu Stickstoff in Deutschland verzögert sich nochmals und gilt nur bis 2024. Die Prüfung des Antragdossiers mit 500 Seiten dauert laut aktueller Aussage der Behörde noch bis April oder Mai 2023. Eine endgültige Zulassung könnte im August 2023 wirksam werden. Siehe Informationen Newsletter RESTAURO vom 08.12.2022
Eine Anfrage im Nov. 2022 an die Pressestelle der BAUA hat folgende Antwort am 21.11.2022 ergeben: Am 5. April 2022 wurde ein Antrag auf Zulassung eines Biozidprodukts basierend auf dem Wirkstoff „in situ hergestellter Stickstoff“ bei der Bundesstelle für Chemikalien (BfC) eingereicht. Derzeit erfolgt die Bewertung durch die zuständigen deutschen Behörden. Aufgrund des derzeitigen Bewertungsstandes rechnet die BfC aktuell mit einer Zulassung des Biozidprodukts in Deutschland im ersten Quartal 2023. Die Zulassung eines solchen Biozidprodukts wird ermöglicht durch den Durchführungsbeschluss (EU) 2020/1265 der Kommission vom 9. September 2020.
UPDATE vom 24.08.2022 Die den Antrag bearbeitende Stelle der BAuA zufolge, kann man mit einem Abschluss des Zulassungsverfahrens für in situ generierten Stickstoff zum Schutz des kulturellen Erbes zum Ende des Jahres 2022 rechnen. Quelle: Rathgen Forschungslabor Berlin.
UPDATE vom 27.01.2022 Ein Ergebnis im nationalen Zulassungsverfahren wird im April 2022 für Deutschland erwartet. Stand: 11.06.2022 (noch unverändert)
Grundlage zur Zulassung von in-situ erzeugtem Stickstoff als Biozid ist die Verordnung (EU) Nr. 528/2012 des Europäischen Parlaments und des Rates vom 22. Mai 2012.
Nach Mitteilung vom Rathgen Forschungslabor aus Berlin am 26.01.2022 wurden die erforderlichen Antragsdokumente zur Produktzulassung und permanenten Wirkstoffgenehmigung für Insitu-generierten Stickstoff bei den zuständigen Stellen der BAuA und ECHA eingereicht.
Weiterhin zulässig ist die Anwendung von Stickstoff in Druckgasflaschen von der Firma Rentokil, die eine Produktzulassung als Produktart 18 (Insektizide) mit dem Handelsnamen „Rentokil N2 Controlled Atmosphere“ seit dem 02.05.2013 besitzt. Der Ablauf der Zulassung endet am 01.09.2022 und soll nach vorliegenden Informationen verlängert werden. Für Deutschland bietet die Firma S&A als Rentokil-Abteilung „Special Application“ seine mobile Begasung (CAT) für Kunstgegenstände und Kunstschätze mit Stickstoff (Wirkstoffgehalt 99,9%) oder auch mit Kohlendioxid (CO2) an. Kohlendioxid ist als Produktart 18 (Insektizide) und 14 (Rodentizide) als Biozid in der EU gelistet.
Rückblick 2020
Der Fördermittelantrag durch die Stiftung Preußischer Kulturbesitz wurde an die Staatsministerin für Kultur und Medien gestellt und ein Beratungsunternehmen für die bürokratische Bearbeitung beauftragt. Weitere Informationen über den Newsletter vom VDR (Stand 09. Feb. 2021) oder das Rathgen Forschungsinstitut Berlin (Bill Landsberger). Die beiden Institutionen ICOM & ICOMOS hatten sich 2020 ebenfalls zum Aufruf zusammengeschlossen, um die Verwendung von Stickstoff zum Schutz des kulturellen Erbes zu ermöglichen! Hier bekam die EU-Kommission fast 1500 Antworten auf eine offene Konsultation zur EU-Verordnung, die eine Verwendung von in-situ-Stickstoff verbietet.
Fortsetzung zum Stickstoffverfahren als Beitrag im Blog der Restauro vom 24.08.2020
In-Situ-Stickstoff-Erzeugung als Beitrag im Blog der Restauro vom 27.01.2020
Überblick andere EU Länder
In Österreich wurde der Bescheid für die zeitlich begrenzte Verwendung von Biozidprodukten mit in situ-erzeugtem Stickstoff zum Schutz des kulturellen Erbes am 05. Mai 2021 erlassen. Österreich ist das erste und bisher einzige Land der EU, wo die offizielle Anwendung im Kulturgutbereich zulässig ist.
In der EU verfügen neben Deutschland nur die acht Länder Österreich, Niederlande, Portugal, Frankreich, Spanien, Dänemark, Polen und Belgien über den Beschluss auf Ausnahmegenehmigung für in-situ-generierten Stickstoff. Hierzu finden sich die einzelnen Angaben bei EUR-Lex. Stand 18.06.2022
Literatur
Baier, U. (2023) In-Situ erzeugter Stickstoff darf wieder verwendet werden, Restauro 7/2023, S. 23
Baier, U. (2021) Neues vom Stickstoff, Restauro 3/2021, S.10
Beckmann, A. (2021) Kunstschätze im Wert von über 700 Mio. in Deutschland gefährdet. Schützen & Erhalten 9, S.72-73
Bloch, Carsten (2019) Das Stickstoff-Problem – Ist Stickstoff ein Biozid oder nicht? Restauro 2/2019, S.30
Toxische Begasung
Anwendung von Begasungsmitteln zur Bekämpfung von Insekten in und an Gebäuden
Bei einer Begasung wird ein Raum oder Gebäude mit einem toxischen Gas geflutet, das durch Objekte wie Holz, Tierpräparate oder Textilien komplett hindurch diffundiert und auch durch anschließendes „Lüften“ wieder entweicht. Durch gasdichte Folien können transportable Gegenstände oder stationäre Objekte (z.B. Kirchenausstattung oder Lagerregale) auch in einer flexiblen Einhausungen begast werden.




Frühere Begasungsmittel waren Methylbromid (Brommethan / MeBr), Phosphin (Phosphorwasserstoff / PH3), Ethylenoxid, Cyanwasserstoff (Hydrogencyanid oder Blausäure / HCN), Schwefelkohlenstoff, Tetrachlorkohlenstoff und Ethylendichlorid. Diese hochtoxischen Gase sind in den meisten Ländern der Erde mittlerweile nicht mehr erlaubt oder finden aufgrund schädlicher Veränderungen an Kunstobjekten schon länger keine Anwendung mehr.
Die toxischen Begasungsmittel Bluefume (HCN) oder Phosphin (PH3) werden aktuell noch in der Schädlingsbekämpfung gegen Insekten oder Schadnager verwendet. Während Bluefume (HCN) als Biozid die Zulassungen für Produktart 8 (Holzschutz), 14 (Rodentizide) und 18 (Insektizide) hat und u.a. bei Rundhölzern oder Balken in Containern zugelassen ist, haben Phosphin-Präparate (Aluminium- oder Calciumphosphid) meist eine Zulassung für die Bekämpfung von z.B. Wühlmäusen usw.
Das Begasungsmittel Vikane mit dem Wirkstoff Sulfuryldifluorid gilt (Stand 08-2024) als einziges zugelassenes gasförmiges Biozid im Bereich Produktart 8 (Holzschutz), welches speziell in Freilichtmuseen oder Kirchen zum Einsatz gegen holzzerstörende Insekten kommt. Die erste Begasung einer Kirche mit Vikane in der Europa, wurde durch Binker 1993 beschrieben. Die Bekämpfung erfolgt i.d.R. gegen den Gemeinen Nagekäfer oder in selteneren Fällen gegen den Hausbockkäfer. In der Produktart 18 (Insektizide) ist der Wirkstoff Sulfuryldifluorid mit dem Namen Profume im Bereich Vorratsschutz zugelassen. Hier können Bekämpfungen gegen Schadinsekten in Gebäuden durchgeführt werden, wie es beispielsweise beim Messingkäfer oder Kugelkäfer (Ptinidae) in historischen Gebäuden der Fall ist. Die Anwendung ist nur konzessionierter Fachfirmen mit firmenbezogener Erlaubnis erlaubt und erfordert langjährige praktische Erfahrungen.
Da die sogenannten „reaktiven Gase“ unter Umständen eine chemische Reaktion mit anderen Materialien eingehen können, ist die Anwendung im kulturhistorischen Bereich eingeschränkt, wenn das Risiko einer möglichen Veränderung von Farben oder Oberflächen bei Objekten besteht. Siehe dazu auch Schäden durch chemische oder physikalische Behandlungen.
Schäden bzw. Objekt-Veränderungen durch reaktive Gase an Objekten oder Gebäuden wurden in der Vergangenheit über die Forschung oder Praxisfälle bekannt (Koestler 1993 oder Emmerling 1995). Bei den bekannteren Schadensfällen handelte es sich überwiegend um Fehlanwendungen (z.B. Phosphin bei Objekten mit Goldfassung) oder ungünstige Bedingungen, wie sehr hohe Luftfeuchten während der Begasung. Vor einer Anwendung empfiehlt sich grundsätzlich eine Risikoabschätzung durch Fachleute wie Restauratoren:innen oder Sachverständige, ob das gewählte Begasungsmittel zu möglichen Schäden oder Veränderungen an Fassungen, Farben oder Pigmenten führen könnte.
Aktuell wird von unterschiedlichen Experten aus ganz Deutschland an dem neuen WTA-Merkblatt 1-18 für Begasung gearbeitet, um ein aktuelles Regelwerk für die Praxis bereitstellen zu können. Die Gründungssitzung der neuen WTA-Arbeitsgruppe mit dem Thema Begasung und modifizierte Atmosphären zur Bekämpfung tierischer Holzzerstörer in Bauwerken aus dem Referat 1 Holz und Holzschutz fand am 20.07.21 in Bronzell bei Fulda statt.
Hinweise:
Häufig wird in der Praxis die Begasung mit anderen Verfahren, wie die Vernebelung oder Sprühen mit einem Kontaktinsektizid, verwechselt. Diese Verfahren dringen aber nicht vollständig durch Objekte, sondern benetzen nur die Oberfläche und töten keine Insekten innerhalb des Behandlungsmaterials.
Eine Behandlung von Objekten oder Räumen mit dem Oxidationsmittel Ozon (O3) ist nicht zulässig oder empfehlenswert. Siehe auch: Technik FAQ.
Aktuelles zur Gesetzgebung:
Neue Einschränkungen beim Schutz von Kulturgut in Deutschland. Am 10.06.22 gab es im deutschen Bundesrat eine Beschluss-Sitzung zu einer geplanten Novellierung der Verordnung des Europäischen Parlaments und Rates über fluorierte Treibhausgase (EU-Richtlinie 2019/1937). Die sogenannten F-Gase kommen in der Kälte- und Klimatechnik zum Einsatz. Das EU-zugelassene Biozidprodukt Sulfuryldifluorid (chemisch SO2F2) steht auf der Liste mit schädlichen F-Gasen, bei der auf europäischer Ebene nicht berücksichtigt wurde, dass es sich um ein nicht substituierbares Mittel zum Erhalt von historischen Gebäuden (u.a. Museumsgebäude, Kirchen, Baudenkmäler) oder beim Export von Handelsgütern handelt. Am 17.04.2024 trafen sich verschiedene Experten aus Deutschland, wie Begasungsfirmen, Herstellervertreter, Wissenschaftler, Behördenvertreter usw., um über Alternativen zu diskutieren und eine gemeinsame Stellungnahme zu verfassen. Am 05.09.2024 gibt der amerikanische Hersteller Douglas Products bekannt, dass einer erneuten Zulassung als Biozid seitens EU nicht stattgegeben wurde. Zur erneuten Zulassung sind seitens Hersteller noch weitere Studien zu erbringen. Zwischenzeitlich könnten unter Umständen nationale Anträge auf Notfallzulassung gestellt werden.
Der deutsche Schädlingsbekämpfer- Berufsverband DSV versucht Einfluss auf die Politik bzw. Bundesregierung zu nehmen, damit die weitere Verwendung von Sulfuryldifluorid im Holz- und Vorratsschutz gewährleistet werden kann. Aktuelle Informationen DSV Online. Letzter Stand 15.09.2024
Literatur
Anonymus: Getty Conservation Institut: Insect Control with the Fumigant Vikane (1986-1990)
Bauer W.P (1989) Methoden u. Probleme der Bekämpfung von Holzschädlingen mittels toxischer Gase, In: Restauratorenblätter Bd. 10 Wien, S. 58-62
Biebl W. (1995) Erfahrungsbericht über die Langzeitwirkung von Begasungen in Bayern. In: Holzschädlingsbekämpfung durch Begasung, Tagungsbericht Nr. 3, Arbeitshefte des Bayerischen Landesamtes für Denkmalpflege, Bd. 75, S. 70-71
Binker G. (1993) Report on the first fumigation of a church in Europe using sulfury fluoride. K. B. Wildey, W.H. Robinson (Hrsg.): Proceedings of the 1st Int. Conf. on Insects Pests in the Urban Enviroment. St. John´s College, Cambridge, 30 June – 3 July 1993, 51-55
Burgess, Helen D., and Nancy E. Binnie (1990) The Effect of Vikane™ on the Stability of Cellulosic and Ligneous Materials — Measurement of Deterioration by Chemical and Physical Methods. MRS Online Proceedings Library 185, Nr. 1. 791–98. Zugriff am 27.07.2021
Dreger I. (2012) Risiko- und Nutzenanalyse zum Einsatz von SF-Gas bei der Bekämpfung von Hausfäulepilzen in Denkmälern In: Beiträge vom 16. EIPOS-Sachverständigentag Holzschutz am 5.Dezember 2012, S.3-22, Fraunhofer IRB Verlag
Emmerling E (1995) Holzschädlingsbekämpfung durch Begasung, In: Holzschädlingsbekämpfung durch Begasung, Tagungsbericht Nr. 3, Arbeitshefte des Bayerischen Landesamtes für Denkmalpflege, Bd. 75, S. 43-57
Grosser D. Rossmann E (1974) Blausäuregas als bekämpf. HS-Mittel für Kunstobjekte, In: Holz a. Roh und Werkstoff 32, S. 108-114
Hertwig N. (2020) Holzschutz im Quadrat. Die Schädlingsbehandlung des Bernöderhofes. In: Jahrbuch für die oberbayerischen Freilichtmuseen Glentleiten und Amerang Jg. 15/2020. S. 106-117
Kenaga E.E. (1957) Some Biological, Chemical and Physical Properties of Sulfuryl Fluoride as an Insecticidal Fumigant, In: Journ. of Econ. Entom. Bd. 50 (1957) No. 1, S. 1-6
Koestler R.J., Parreira E (1993) Visual effects of selected biocides on easel painting materials In: Studies in Conservation 38, S. 265-273
Liese W., Knigge H., Rütze M. (1981) Fumigation Experiments with Methyl Bromide on Oak Wood, In: Material u. Organismen 16, S. 265-280
Mori H. and Kumagat M. (1954) Damage to antiquities caused by fumigants. I Metals. Scientific Papers of Japanese Antiques and Art Crafts 8. 17
Reichmuth, C. (1991) New techniques in fumigation research today. In: Fleurat-Lessard, F., P. Ducom, (Eds.): Proceedings of the 5th International Working Conference on stored-Product Protection. 9-14 September 1990 in Boredeaux, France, Imprimerie Médocaine, Blanquefort Cedex, 2066 pp, Vol 2, 709-725.
Reichmuth, C. (2007) Fumigants for pest control in wood protection. In: Noldt, U., H. Michels, (Eds.): Holzschädlinge im Fokus – Alternative Maßnahmen zur Erhaltung historischer Gebäude. Beiträge der internationalen Tagung im LWL-Freilichtmuseum Detmold. 28.-30. 6. 2006 im Westfälischen Landesmuseum für Volkskunde in Detmold, Schriften des LWL-Freilichtmuseums Detmold, Westfälisches Landsmuseum für Volkskunde, herausgegeben im Auftrage des Landschaftsverbandes Westfalen-Lippe von Carstensen, J., Bd. 27, Merkur Verlag, Detmold, 265 S., 137-162.
Unger A. (1993) Begasung von Kulturgütern: Grundlagen-Materialien-Entwicklungen. In: Holzschädlingsbekämpfung durch Begasung, Tagungsbericht Nr. 3, Arbeitshefte des Bayerischen Landesamtes für Denkmalpflege, Bd. 75, S. 19-27
Williams L.H., Sprenkel R.J. (1990) Ovicidal Activity of Sulfuryl Fluoride to Anobiid and Lyctid Beetle Eggs of Various Ages, In: Journ. of entomol. Science 25, S. 366-375
Untersuchung mit Hilfsmitteln
Folgende Hilfsmittel können zur Unterstützung beim Monitoring oder Überprüfen genutzt werden:
- Persönliche Schutzausrüstung (kontaminierte Bereiche)
- Taschenlampe / Stirnlampe (notfalls Smartphone mit Lampe)
- Probetöpfchen (zum Aufsammeln von Insekten)
- Digitalkamera bzw. Smartphone, ggf. mit Aufsatzlupe
- Notizblock bzw. Smartphone
- Lageplan des Gebäudes oder Räume
- Thermohygrometer (Klima)
- Lupe / Smartphone mit Aufsatzlupe / USB-Digital-Mikroskop
- Bestimmungshilfen (Buch, Insektenbilder oder digitale Bestimmungsschlüssel wie „Offene Naturführer.de“

Aufsatzlupe für Smartphone mit Lampe
Suchbegriffe Internet: 60x Zoom Mikroskop Lupe, Handy mikroskop, LED + Uv Licht Clip on Mikroobjektiv für Universal Mobiltelefone (60x Mit Clip)
Vorteile: mit Lichtquelle, optimal für unterwegs, günstiger Preis
Nachteile: Schatten bei Aufnahme möglich, da Licht von Seite, Batteriebetrieb

Aufsatzlupe für Smartphone
Vorteile: ohne Batterie nutzbar, optimal für unterwegs, verschiedene Objektive möglich, günstiger Preis
Nachteile: ohne Lichtquelle

Wi-Fi Digital Mikroskop 1000x, USB-Digital
Vorteile: hohe Auflösung, 8fach LED-Licht, Übertragung auf Mobiltelefon, Aufladung über Kabel
Nachteile: nicht optimal für unterwegs

Probetöpfchen zum Sammeln für Insekten
zur weiteren Bestimmung im Labor
Papierabklebungen (Holzschädlinge)

Akustisches Aktivitäts-Detektions-System für holzzerstörende Insekten (IADS).
Nachweis der Aktivität von verschiedenen Larven, wie z.B. Nagekäfer, Splintholzkäfer oder Hausbock im Holz mittels Schallemission

Akku-Inspektionskamera (Video-Endoskop) für die Untersuchung von Hohlräumen

Weitere Methoden zur Detektion von Insekten, wie z.B. Röntgenstrahlung, Thermografie, akustische Schallemissions-Messung usw. sind in der nachfolgenden Literaturliste zu finden.
Biologische Hilfsmittel

Erste Feldversuche zeigten, dass trainierte Spürhunde auch zum Aufspüren eines Insektenbefalls helfen können
(Bildquelle Querner)

DNA-Barcoding zur taxonomischen Bestimmung von Tieren, Pflanzen und Pilzen.
In Deutschland über den GBOL German Barcode of Life durch Inventarisierung und genetische Charakterisierung.
Hinweis: siehe Insektenbestimmung Thema Metabarcoding
Literatur
Al-Doski J. et. al. (2016) Thermal Imaging for Pests Detecting – A review. International Journal of Agriculture, Forestry and Plantation, Vol. 2, 10-30
Arbat S. et al. (2021) The Case History of an Insect Infestation Revealed Using X-ray Computed Tomography and Implications for Museum Collections Management Decisions. Heritage 4, 1016–1025 The Case History of an Insect Infestation Revealed Using X-ray Computed Tomography and Implications for Museum Collections Management Decisions (researchgate.net)
Becker, M, Berger, B, König, S, Taddei, A, Hoppe, B, Plinke, B (2020): Innovative Diagnosemethoden zum Nachweis holzzerstörender Insekten. In: Journal für Kulturpflanzen 72(8), 453-465
Biebl S. und Wapler G. (2023) Dem Holzwurm auf der Spur. Akustische Aktivitäts-Detektion von holzzerstörenden Insekten. Der praktische Schädlingsbekämpfer, Ausgabe 1, S. 16-17
Creemers, J G M (2015): Use of Acoustic Emission (AE) to Detect Activity of Common European Dry-Woodboring Insects: Practical Considerations. Int. Symp. Non-Destructive Testing in Civil Engineering (NDT-CE), Berlin, Germany, 573-580.
Kerner G., Thiele H., Unger W (1980) Gesicherte u. zerstörungsfreie Ortung der Larven holzzerstörender Insekten im Holz, In: Holztechnologie 21 (3). S 131-137
Krajewski A et al (2020) The progress in the research of AE detection method of old house borer larvae (Hylotrupes bajulus L.) in wooden structures. Construction and Building Materials 256
Lewis V. et al (1997) Evaluation of dog-assisted searches and electronic odor devices for detecting the western subterranean termite. Forest Product Journal. Vol. 47, No.10. 79-84
Morinière J. et. al (2019) A DNA barcode library for 5,200 German flies and midges (Insecta: Diptera) and its implications for metabarcoding-based biomonitoring. Mol Ecol Resour. 19. 900–928.
Müller-Blenkle, C., S. Kirchner, I. Szallies und Adler C. (2018) A new approach to acoustic insect detection in grain storage. Submitted to the Proceedings of the 12th International Working Conference on Stored Product Protection Berlin, Germany, October 7-11. Akustische Früherkennung von vorratsschädlichen Insekten in Getreide
Noldt, U (2014): Insekten. In: Binker, G, Brückner, G, Flohr, E, Huckfeldt, T, Noldt, U, Parisek, L, Rehbein, M, Wegner, R: Praxis-Handbuch Holzschutz – Beurteilen, Vorbereiten, Ausführen. Verlag Rudolf Müller, Köln, p. 112-153.
Pamplona M. and Grosse C. (2019) Zerstörungsfreie Prüftechniken für die Anwendung an technischen Kulturgütern in Museen. DGFzP Jahrestagung. S. 1-7
Querner P. und Sauseng G. (2019) Spürhundearbeit im Integrated Pest Management. Restauro 2. S. 44-49
Sachs J, Helbig M, Renhak K (2008): Unsichtbares wird sichtbar – Mit Radar den Insekten auf der Spur. Dokumentation zum Kongress des Deutschen Holz- und Bautenschutzverbandes in Kooperation mit der WTA 30. und 31. Oktober 2008, Landschaftspark Duisburg-Nord. Hrsg.: Deutscher Holz- und
Bautenschutzverband e.V., Köln, 45-48
Schmidt R., Göller S., Hertel H. (1995) Computerized detection of feeding sounds from wood boring beetle larvae. Material und Organismen. 295-304
Tscherne F. (2016) Schadensbegutachtung an Holzkonstruktionen. In: EIPOS-Tagungsband Holzschutz 2016, Fraunhofer IRB Verlag, S. 65-75
Vaiedelich, S. and S. Le Conte (2013) In situ acoustical detection of Xylophage. Programme International Conference on IPM in museums, archives and historic houses, Vienna 2013: 70
Warmluftverfahren


Feuchtegeregeltes Warmluftverfahren in Situ
Das spezielle Verfahren zur Schädlingsbekämpfung kommt sowohl bei Dachstühlen oder Kirchtürmen, bei Kircheneinrichtungen sowie auch bei Fachwerkhäusern und Museumsgut zur Anwendung. Eine getrennte Rauchgasführung kennzeichnet die Anlagentechnik gegenüber dem herkömmlichen Heißluft-Verfahren (siehe Absatz unten: Heißluft-Verfahren) aus.
Zur Holzschädlingsbekämpfung mit feuchtegeregelter Warmluft werden die Objekte bis auf 52 – 55 °C erwärmt, was zu einer Denaturierung der tierischen Eiweiße führt. Entscheidend für eine erfolgreiche, schonende Holzschädlingsbekämpfung sind die exakte Regelung der relativen Feuchte nach dem Keylwerth Diagramm und eine nur schrittweise Temperaturerhöhung.
Nur sehr wenige Fachfirmen mit langjähriger Erfahrung verfügen über das nötige Know-How und die notwendige Spezialtechnik für die Anwendung bei musealen oder historischen Objekten, wie nachfolgende Bilder zeigen:




Literatur Warmluft
Siehe Wärmebehandlung
(weiterlesen…)